马дёҠжіЁеҶҢпјҢз»“дәӨжӣҙеӨҡеҘҪеҸӢпјҢдә«з”ЁжӣҙеӨҡеҠҹиғҪпјҢи®©дҪ иҪ»жқҫзҺ©иҪ¬зӨҫеҢәгҖӮ
жӮЁйңҖиҰҒ зҷ»еҪ• жүҚеҸҜд»ҘдёӢиҪҪжҲ–жҹҘзңӢпјҢжІЎжңүиҙҰеҸ·пјҹз«ӢеҚіжіЁеҶҢ

x
еҸ—иҜ•иҖ…жӢӣеӢҹпјҲ6пјү
з ”з©¶иҚҜзү©пјҡEncorafenibдёҺиҘҝеҰҘжҳ”еҚ•жҠ—иҒ”з”Ё
EncorafenibдёҺиҘҝеҰҘжҳ”еҚ•жҠ—иҒ”з”Ёд»Ӣз»Қ
з ”з©¶иҚҜзү©пјҡEncorafenibпјҲеә·еҘҲйқһе°јпјүпјҡеҸЈжңҚBRAFжҠ‘еҲ¶еүӮпјӣиҘҝеҰҘжҳ”еҚ•жҠ—пјҡEGFRжҠ‘еҲ¶еүӮ
еә·еҘҲйқһе°јBraftoviпјҲencorafenibпјүжҳҜдёҖз§ҚеҸЈжңҚе°ҸеҲҶеӯҗBRAFжҠ‘еҲ¶еүӮпјҢBRAF еҹәеӣ дҪҚдәҺжҹ“иүІдҪ“ 7q34пјҢзј–з Ғдёқж°Ёй…ё/иӢҸж°Ёй…ёиӣӢзҷҪжҝҖй…¶пјҢжҳҜ RAF 家ж—ҸжҲҗе‘ҳгҖӮBRAF иӣӢзҷҪдёҺ KRAS иӣӢзҷҪеҗҢдёә RAS-RAF-MEK-ERK дҝЎеҸ·йҖҡи·ҜдёӯдёҠжёёи°ғиҠӮеӣ еӯҗпјҢдҪҝ MEK иӣӢзҷҪзЈ·й…ёеҢ–пјҢйҡҸеҗҺ ERK иӣӢзҷҪзЈ·й…ёеҢ–пјҢзі»жҝҖжҙ»еҸӮдёҺз»Ҷиғһеўһж®–е’Ңз”ҹеӯҳзҡ„зӣёе…іеҹәеӣ гҖӮзӘҒеҸҳзҡ„ BRAF иӣӢзҷҪеўһејәдәҶжҝҖй…¶зҡ„жҙ»жҖ§пјҢеҸҜеңЁдҪ“еӨ–иҪ¬еҢ–гҖӮиҖҢе…¶дёӯе…·жңүиҮҙзҷҢд»ҘеҸҠжІ»з–—д»·еҖјзҡ„жҳҜ V600 зӘҒеҸҳпјҢдё»иҰҒеҢ…жӢ¬ V600E е’Ң V600K зӘҒеҸҳгҖӮ
иҘҝеҰҘжҳ”еҚ•жҠ—жҳҜEGFRжҠ‘еҲ¶еүӮпјҢеҸҜдёҺиЎЁиҫҫдәҺжӯЈеёёз»Ҷиғһе’ҢеӨҡз§ҚзҷҢз»ҶиғһиЎЁйқўзҡ„EGFRеҸ—дҪ“зү№ејӮжҖ§з»“еҗҲпјҢ并з«һдәүжҖ§йҳ»ж–ӯEGFRе’Ңе…¶д»–й…ҚдҪ“пјҢеҰӮОұиҪ¬еҢ–з”ҹй•ҝеӣ еӯҗпјҲTGF-Оұпјүзҡ„з»“еҗҲгҖӮжҳҜй’ҲеҜ№EGFRеҸ—дҪ“зҡ„IgG1еҚ•е…ӢйҡҶжҠ—дҪ“пјҢдёӨиҖ…зү№ејӮжҖ§з»“еҗҲеҗҺпјҢйҖҡиҝҮеҜ№дёҺEGFеҸ—дҪ“з»“еҗҲзҡ„й…Әж°Ёй…ёжҝҖй…¶пјҲTKпјүзҡ„жҠ‘еҲ¶дҪңз”ЁпјҢйҳ»ж–ӯз»ҶиғһеҶ…дҝЎеҸ·иҪ¬еҜјйҖ”еҫ„пјҢд»ҺиҖҢжҠ‘еҲ¶зҷҢз»Ҷиғһзҡ„еўһж®–пјҢиҜұеҜјзҷҢз»Ҷиғһзҡ„еҮӢдәЎпјҢеҮҸе°‘еҹәиҙЁйҮ‘еұһиӣӢзҷҪй…¶е’ҢиЎҖз®ЎеҶ…зҡ®з”ҹй•ҝеӣ еӯҗзҡ„дә§з”ҹгҖӮ
гҖӮ
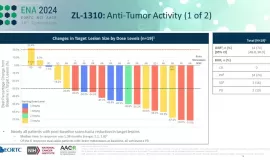
йҖӮеә”з—ҮпјҡдёҖзәҝжІ»з–—еӨұиҙҘзҡ„BRAFV600EзӘҒеҸҳиҪ¬з§»жҖ§з»“зӣҙиӮ зҷҢжӮЈиҖ…
йЎ№зӣ®еҲҶжңҹпјҡIIжңҹ
иҜ•йӘҢзұ»еһӢпјҡе№іиЎҢеҲҶз»„
еҸӮеҠ ж ҮеҮҶ
1гҖҒиғҪжҸҗдҫӣд№ҰйқўзҹҘжғ…еҗҢж„ҸпјҢ并зҗҶи§Јдё”еҗҢж„ҸйҒөеҫӘз ”з©¶иҰҒжұӮе’ҢиҜ„дј°и®ЎеҲ’иЎЁгҖӮ
2гҖҒзҹҘжғ…еҗҢж„Ҹж—¶е№ҙйҫ„вүҘ18еІҒзҡ„дёӯеӣҪз”·жҖ§жҲ–еҘіжҖ§еҸ—иҜ•иҖ…гҖӮ
3гҖҒз ”з©¶иҝӣе…Ҙж—¶пјҢжңүз»„з»ҮеӯҰжҲ–з»ҶиғһеӯҰиҜҒе®һзҡ„иҪ¬з§»жҖ§дё”ж— жі•еҲҮйҷӨзҡ„CRCпјҲеҚіпјҢзӯӣйҖүж—¶дёҚйҖӮеҗҲе®Ңе…ЁжүӢжңҜеҲҮйҷӨпјүгҖӮ
4гҖҒд№ӢеүҚж №жҚ®зӯӣйҖүеүҚд»»дҪ•ж—¶й—ҙзҡ„еҪ“ең°жЈҖжөӢжҲ–дёӯеҝғе®һйӘҢе®ӨжЈҖжөӢзЎ®е®ҡиӮҝзҳӨз»„з»ҮдёӯеӯҳеңЁBRAF V600EзӘҒеҸҳгҖӮ
5гҖҒиғҪеӨҹжҸҗдҫӣи¶іеӨҹж•°йҮҸзҡ„д»ЈиЎЁжҖ§иӮҝзҳӨж ·жң¬иҝӣиЎҢдёӯеҝғе®һйӘҢе®ӨеүҚзһ»жҖ§BRAFзӘҒеҸҳзҠ¶жҖҒйӘҢиҜҒжЈҖжҹҘеҸҠеӣһйЎҫжҖ§RAS wtзҠ¶жҖҒе’ҢMSIжЈҖжҹҘгҖӮ жіЁпјҡд»ЈиЎЁжҖ§иӮҝзҳӨж ·жң¬пјҡеҺҹеҸ‘жҲ–иҪ¬з§»гҖҒеӯҳжЎЈжҲ–ж–°иҺ·еҫ—гҖӮ
6гҖҒе°ұиӮҝзҳӨRASзӘҒеҸҳзҠ¶жҖҒпјҲеҚіпјҢжү№еҮҶз”ЁдәҺRAS wtзҠ¶жҖҒпјүиҖҢиЁҖпјҢдҫқз…§дёӯеӣҪжү№еҮҶзҡ„иҜҙжҳҺд№ҰпјҢжңүиө„ж јжҺҘеҸ—иҘҝеҰҘжҳ”еҚ•жҠ—гҖӮ
7гҖҒиҪ¬з§»еҗҺжҺҘеҸ—дёҖз§ҚжҲ–дёӨз§Қж—ўеҫҖж–№жЎҲжІ»з–—еҗҺз–ҫз—…иҝӣеұ•гҖӮ жіЁ пјҡ a.еҜ№дәҺжІ»з–—жңҹй—ҙжҲ–иҫ…еҠ©жІ»з–—еҗҺ6дёӘжңҲеҶ…еӨҚеҸ‘зҡ„з–ҫз—…пјҢи®ӨдёәеҜ№еә”зҡ„жІ»з–—дёәиҪ¬з§»жҖ§з–ҫз—…жІ»з–—гҖӮ b.иҪ¬з§»иғҢжҷҜдёӢз»ҷдәҲзҡ„з»ҙжҢҒжІ»з–—дёҚеҪ’зұ»дёәеҚ•зӢ¬ж–№жЎҲгҖӮ
8гҖҒдҫқжҚ®RECIST 1.1зүҲиҜҒжҳҺз–ҫз—…еҸҜжөӢйҮҸгҖӮ жіЁпјҡж—ўеҫҖж”ҫз–—жҲ–е…¶д»–еұҖйғЁжІ»з–—еҢәеҹҹеҶ…зҡ„з—…еҸҳдёҚеұһдәҺеҸҜжөӢйҮҸз–ҫз—…пјҢдҪҶеңЁжІ»з–—еҗҺдәҺиҜҘеұҖеҹҹдёӯи®°еҪ•еҲ°з–ҫз—…иҝӣеұ•ж—¶дҫӢеӨ–гҖӮ
9гҖҒECOGдҪ“иғҪзҠ¶жҖҒиҜ„еҲҶдёә0жҲ–1еҲҶгҖӮ
10гҖҒзӯӣйҖүе’Ңеҹәзәҝж—¶е…·жңүе……и¶ізҡ„йӘЁй«“еҠҹиғҪпјҢиҰҒжұӮеҰӮдёӢпјҡ a. з»қеҜ№дёӯжҖ§зІ’з»Ҷиғһи®Ўж•° вүҘ1.5 Г— 109/LгҖӮ b. иЎҖе°Ҹжқҝ вүҘ100 Г— 109/LгҖӮ c. иЎҖзәўиӣӢзҷҪ вүҘ9.0 g/dLгҖӮе…Ғи®ёеҸ—иҜ•иҖ…жҺҘеҸ—иҫ“иЎҖжІ»з–—пјҢдҪҶеүҚжҸҗжҳҜеҸ—иҜ•иҖ…зӯӣйҖүеүҚ4 е‘ЁдёӯжҺҘеҸ—зҡ„зәўз»Ҷиғһиҫ“жіЁдёҚи¶…иҝҮдёӨдёӘеҚ•дҪҚгҖӮ
11гҖҒзӯӣйҖүе’Ңеҹәзәҝж—¶е…·жңүе……и¶ізҡ„иӮҫеҠҹиғҪпјҡ a. иЎҖжё…иӮҢй…җ вүӨ1.5 Г— жӯЈеёёеҖјдёҠйҷҗпјҲULNпјүжҲ– b. ж №жҚ®Cockcroft-Gault е…¬ејҸи®Ўз®—еҗҺзҡ„иӮҢй…җжё…йҷӨзҺҮвүҘ50 mL/minгҖӮ
12гҖҒзӯӣйҖүе’Ңеҹәзәҝж—¶е…·жңүе……и¶ізҡ„з”өи§ЈиҙЁпјҢеҚіпјҢиЎҖжё…й’ҫе’Ңй•Ғж°ҙе№ідҪҚдәҺжңәжһ„зҡ„жӯЈеёёйҷҗеҖјеҶ…гҖӮ жіЁпјҡдёәиҺ·еҫ—е……и¶ізҡ„з”өи§ЈиҙЁпјҢе…Ғи®ёз»ҷдәҲжӣҝд»ЈжІ»з–—гҖӮ
13гҖҒзӯӣйҖүе’Ңеҹәзәҝж—¶е…·жңүеҗҲйҖӮзҡ„иӮқеҠҹиғҪпјҢиҰҒжұӮеҰӮдёӢпјҡ a. иЎҖжё…жҖ»иғҶзәўзҙ вүӨ1.5 Г— ULNе’Ң<2 mg/dLгҖӮ жіЁпјҡиӢҘй—ҙжҺҘиғҶзәўзҙ вүӨ1.5 Г— ULNпјҢе…Ғи®ёжҖ»иғҶзәўзҙ >1.5 Г— ULNе’ҢвүҘ2 mg/dLгҖӮ c.дёҷж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶пјҲALTпјүе’Ң/жҲ–еӨ©еҶ¬ж°Ёй…ёж°ЁеҹәиҪ¬з§»й…¶пјҲASTпјү вүӨ2.5 Г— ULNжҲ–иӮқиҪ¬з§»ж—¶вүӨ5 Г— ULNгҖӮ
14гҖҒзӯӣйҖүж—¶пјҢжҚ®Fridericiaе…¬ејҸгҖҒеҝғзҺҮж ЎжӯЈеҗҺзҡ„QTй—ҙжңҹпјҲQTcFпјүзҡ„дёүж¬ЎжөӢе®ҡзҡ„е№іеқҮеҖјвүӨ480 msecгҖӮ
15гҖҒеҸ—иҜ•иҖ…иғҪеӨҹеҸЈжңҚиҚҜзү©гҖӮ
16гҖҒж„ҝж„Ҹдё”жңүиғҪеҠӣйҒөеҫӘи®ЎеҲ’и®ҝи§ҶгҖҒжІ»з–—и®ЎеҲ’гҖҒе®һйӘҢе®ӨжЈҖжҹҘе’Ңе…¶д»–з ”з©¶зЁӢеәҸгҖӮ
17гҖҒеҘіжҖ§еҸ—иҜ•иҖ…жҲ–иҖ…з»қз»ҸиҮіе°‘1е№ҙпјҢжҲ–иҖ…жүӢжңҜз»қиӮІиҮіе°‘6е‘ЁпјҢжҲ–иҖ…еҝ…йЎ»еҗҢж„ҸйҮҮеҸ–йҖӮеҪ“зҡ„йҒҝеӯ•жҺӘж–ҪгҖӮ
жіЁпјҡеҸӮи§Ғз« иҠӮ5.3.1гҖҒйҷ„еҪ•10.2.1е’Ңйҷ„еҪ•10.2.2гҖӮ
18гҖҒз”·жҖ§еҸ—иҜ•иҖ…еҝ…йЎ»еҗҢж„ҸйҮҮеҸ–йҖӮеҪ“зҡ„йҒҝеӯ•жҺӘж–Ҫйў„йҳІй…ҚеҒ¶жҖҖеӯ•гҖӮ жіЁпјҡеҸӮи§Ғз« иҠӮ5.3.1е’Ңйҷ„еҪ•10.2.2гҖӮ
жҺ’йҷӨж ҮеҮҶ
дёҖгҖҒеҲҶеӯҗйў„зӯӣзҡ„жҺ’йҷӨж ҮеҮҶпјҲз¬ҰеҗҲд»ҘдёӢд»»дёҖж ҮеҮҶзҡ„еҸ—иҜ•иҖ…ж— иө„ж јжҺҘеҸ—еҲҶеӯҗиӮҝзҳӨйў„зӯӣпјү
1гҖҒж—ўеҫҖжҺҘеҸ—иҝҮжҠ—EGFRжІ»з–—
2гҖҒиҪ¬з§»иғҢжҷҜдёӢжҺҘеҸ—иҝҮи¶…иҝҮдёӨз§Қж—ўеҫҖж–№жЎҲгҖӮ жіЁ пјҡ a.еҜ№дәҺжІ»з–—жңҹй—ҙжҲ–иҫ…еҠ©жІ»з–—еҗҺ6дёӘжңҲеҶ…еӨҚеҸ‘зҡ„з–ҫз—…пјҢи®ӨдёәеҜ№еә”зҡ„жІ»з–—дёәиҪ¬з§»жҖ§з–ҫз—…жІ»з–—гҖӮ b.иҪ¬з§»иғҢжҷҜдёӢз»ҷдәҲзҡ„з»ҙжҢҒжІ»з–—дёҚеҪ’зұ»дёәеҚ•зӢ¬ж–№жЎҲгҖӮ
3гҖҒдҫқз…§жңҖж–°зҡ„иҘҝеҰҘжҳ”еҚ•жҠ—е’ҢдјҠз«Ӣжӣҝеә·еҪ“ең°иҜҙжҳҺд№ҰпјҢе·ІзҹҘжңүжҢүз…§и®ЎеҲ’еүӮйҮҸжҺҘеҸ—иҘҝеҰҘжҳ”еҚ•жҠ—жҲ–дјҠз«Ӣжӣҝеә·зҡ„зҰҒеҝҢз—ҮгҖӮ
4гҖҒе·ІзҹҘжңүеҗүе°”дјҜзү№ж°Ҹз»јеҗҲеҫҒз—…еҸІжҲ–жңүд»ҘдёӢд»»дёҖеҹәеӣ еһӢпјҡе°ҝиӢ·5'-дәҢзЈ·й…ё-и‘Ўзі–йҶӣй…ёиҪ¬з§»й…¶пјҲUGTпјү1A1*6/*6гҖҒUGT1A1*28/*28жҲ–UGT1A1*6/*28гҖӮ жіЁпјҡдёҚйҖӮз”ЁдәҺз ”з©¶е®үе…ЁжҖ§еҜје…Ҙжңҹе…Ҙз»„зҡ„еҸ—иҜ•иҖ…гҖӮ
5гҖҒжҹ”и„‘иҶңз–ҫз—…гҖӮ
6гҖҒе·ІзҹҘз ”з©¶жІ»з–—ејҖе§ӢеүҚ6дёӘжңҲеҶ…жңүжҖҘжҖ§жҲ–ж…ўжҖ§иғ°и…әзӮҺз—…еҸІгҖӮ
7гҖҒе·ІзҹҘз ”з©¶жІ»з–—ејҖе§ӢеүҚвүӨ12дёӘжңҲжңүйңҖиҰҒеҢ»еӯҰе№Ійў„зҡ„ж…ўжҖ§зӮҺжҖ§иӮ з—…жҲ–е…ӢзҪ—жҒ©з—…зҡ„з—…еҸІгҖӮ жіЁпјҡеҢ»еӯҰе№Ійў„жҢҮе…Қз–«и°ғиҠӮжҲ–е…Қз–«жҠ‘еҲ¶иҚҜзү©зӯүзҡ„еҶ…科治疗жҲ–еӨ–科治疗гҖӮ
8гҖҒе·ІзҹҘжңүдәәзұ»е…Қз–«зјәйҷ·з—…жҜ’пјҲHIVпјүйҳіжҖ§жЈҖжҹҘз»“жһңжҲ–е·ІзҹҘжӮЈжңүиҺ·еҫ—жҖ§е…Қз–«зјәйҷ·з»јеҗҲеҫҒпјҲAIDSпјүзҡ„з—…еҸІгҖӮHIVжЈҖжөӢеҝ…йЎ»еңЁжңүжқғиҝӣиЎҢжЈҖжөӢзҡ„еҪ“ең°зҡ„з ”з©¶дёӯеҝғиҝӣиЎҢгҖӮ
9гҖҒжүҖеӨ„иҒҢдҪҚеҸҜиғҪеҜјиҮҙеҲ©зӣҠеҶІзӘҒгҖӮ
дәҢгҖҒжІ»з–—жңҹжҺ’йҷӨж ҮеҮҶпјҲз¬ҰеҗҲд»ҘдёӢд»»дёҖж ҮеҮҶзҡ„еҸ—иҜ•иҖ…ж— иө„ж јеҸӮеҠ жң¬з ”究пјү
1гҖҒж—ўеҫҖжҺҘеҸ—иҝҮд»»дҪ•RAFжҠ‘еҲ¶еүӮгҖҒиҘҝеҰҘжҳ”еҚ•жҠ—гҖҒеё•е°јеҚ•жҠ—жҲ–е…¶д»–EGFRжҠ‘еҲ¶еүӮзҡ„жІ»з–—гҖӮ
2гҖҒз—ҮзҠ¶жҖ§и„‘иҪ¬з§»гҖӮ жіЁпјҡиӢҘж— зҡ®иҙЁзұ»еӣәйҶҮе’ҢжҠ—зҷ«з—«жІ»з–—пјҢд№ӢеүҚеӣ иҝҷдәӣз—…з—ҮжҺҘеҸ—иҝҮжІ»з–—жҲ–жңӘжҺҘеҸ—иҝҮжІ»з–—зҡ„ж— з—ҮзҠ¶еҸ—иҜ•иҖ…е…Ғи®ёе…Ҙз»„гҖӮж №жҚ®еҪұеғҸеӯҰжЈҖжҹҘпјҲдҫӢеҰӮпјҢи„‘MRIжҲ–CTиҜҒжҳҺзӯӣйҖүж—¶ж— и„‘иҪ¬з§»иҝӣеұ•зҡ„иҜҒжҚ®пјүпјҢи„‘иҪ¬з§»еҝ…йЎ»зЁіе®ҡвүҘ4е‘ЁгҖӮ
3гҖҒжҹ”и„‘иҶңз–ҫз—…гҖӮ
4гҖҒз ”з©¶жІ»з–—ејҖе§ӢеүҚвүӨ1е‘ЁдҪҝз”ЁиҝҮд»»дҪ•дёӯиҚүиҚҜ/иЎҘе……еүӮжҲ–д»»дҪ•еұһдәҺз»ҶиғһиүІзҙ P450пјҲCYPпјү3A4/5дёӯж•ҲжҲ–ејәж•ҲжҠ‘еҲ¶еүӮжҲ–иҜұеҜјеүӮзҡ„иҚҜзү©жҲ–йЈҹзү©гҖӮ жіЁпјҡ a.е…¶дёӯпјҢдёӯиҚүиҚҜеҢ…жӢ¬дҪҝз”ЁиҙҜеҸ¶иҝһзҝҳпјҲйҮ‘дёқжЎғпјүе’Ңе·ІзҹҘеұһдәҺCYP3A4/5дёӯж•ҲжҲ–ејәж•ҲжҠ‘еҲ¶еүӮжҲ–иҜұеҜјеүӮзҡ„дёӯиҚҜгҖӮ b.дёҚиҝҮпјҢеҜ№дәҺејҖе§Ӣз ”з©¶жІ»з–—еүҚиҮіе°‘7еӨ©е·Із»ҸдёӯжӯўCYP3A4/5дёӯж•ҲжҲ–ејәж•ҲжҠ‘еҲ¶еүӮжҲ–иҜұеҜјеүӮжҲ–ж”№з”ЁеҸҰдёҖз§ҚиҚҜзү©зҡ„еҸ—иҜ•иҖ…пјҢжңүиө„ж јеҸӮеҠ гҖӮ
5гҖҒе·ІзҹҘз ”з©¶жІ»з–—ејҖе§ӢеүҚ6дёӘжңҲеҶ…жңүжҖҘжҖ§жҲ–ж…ўжҖ§иғ°и…әзӮҺз—…еҸІгҖӮ
6гҖҒе·ІзҹҘз ”з©¶жІ»з–—ејҖе§ӢеүҚвүӨ12дёӘжңҲжңүйңҖиҰҒеҢ»еӯҰе№Ійў„зҡ„ж…ўжҖ§зӮҺжҖ§иӮ з—…жҲ–е…ӢзҪ—жҒ©з—…зҡ„з—…еҸІгҖӮ жіЁпјҡеҢ»еӯҰе№Ійў„жҢҮе…Қз–«и°ғиҠӮжҲ–е…Қз–«жҠ‘еҲ¶иҚҜзү©зӯүзҡ„еҶ…科治疗жҲ–еӨ–科治疗гҖӮ
7гҖҒеҝғиЎҖз®ЎеҠҹиғҪеҸ—жҚҹжҲ–дёҙеәҠдёҠжҳҫи‘—зҡ„еҝғиЎҖз®Ўз–ҫз—…пјҢеҢ…жӢ¬д»ҘдёӢд»»дёҖжғ…еҶөпјҡ a. з ”з©¶жІ»з–—ејҖе§ӢеүҚвүӨ6дёӘжңҲжңүжҖҘжҖ§еҝғиӮҢжў—жӯ»гҖҒжҖҘжҖ§еҶ и„үз»јеҗҲеҫҒпјҲеҢ…жӢ¬дёҚзЁіе®ҡеһӢеҝғз»һз—ӣгҖҒеҶ зҠ¶еҠЁи„үж—Ғи·Ҝ移жӨҚжңҜгҖҒеҶ зҠ¶еҠЁи„үиЎҖз®ЎжҲҗеҪўжңҜжҲ–ж”Ҝжһ¶ж”ҫзҪ®жңҜпјүз—…еҸІгҖӮ b. з—ҮзҠ¶жҖ§е……иЎҖжҖ§еҝғеҠӣиЎ°з«ӯпјҲеҚіпјҢзәҪзәҰеҝғи„ҸеӯҰдјҡ3зә§жҲ–д»ҘдёҠпјүгҖӮ c. з ”з©¶жІ»з–—ејҖе§ӢеүҚвүӨ6дёӘжңҲжңүдёҙеәҠдёҠжҳҫи‘—зҡ„еҝғеҫӢеӨұеёёе’Ң/жҲ–дј еҜјејӮеёёзҡ„з—…еҸІжҲ–зҺ°з—…еҸІпјҢдёҚеҢ…жӢ¬жҲҝйўӨе’ҢйҳөеҸ‘жҖ§е®ӨдёҠжҖ§еҝғеҠЁиҝҮйҖҹгҖӮ
8гҖҒжңӘеҫ—еҲ°жҺ§еҲ¶зҡ„йҮҚеәҰй«ҳиЎҖеҺӢпјҢеҚіпјҢиҷҪз»ҷдәҲжІ»з–—пјҢдҪҶ收缩еҺӢжҢҒз»ӯеҚҮй«ҳиҮівүҘ150 mmHgжҲ–иҲ’еј еҺӢвүҘ100 mmHgгҖӮ
9гҖҒиӮқеҠҹиғҪеҸ—жҚҹпјҢеҚіпјҢChild-Pugh Bзұ»жҲ–Cзұ»гҖӮ
10гҖҒе·ІзҹҘжңүеҗүе°”дјҜзү№ж°Ҹз»јеҗҲеҫҒз—…еҸІжҲ–жңүд»ҘдёӢд»»дёҖеҹәеӣ еһӢпјҡUGT1A1*6/*6гҖҒUGT1A1*28/*28жҲ–UGT1A1*6/*28гҖӮ жіЁпјҡдёҚйҖӮз”ЁдәҺз ”з©¶е®үе…ЁжҖ§еҜје…Ҙжңҹе…Ҙз»„зҡ„еҸ—иҜ•иҖ…гҖӮ
жү«з ҒжҠҘеҗҚ
еҰӮжһңжӮЁжңүж„Ҹж„ҝеҸӮдёҺеҲ°дёҙеәҠиҜ•йӘҢдёӯпјҢиҜ·жү«жҸҸдәҢз»ҙз Ғж·»еҠ е°ҸеҠ©жүӢеҫ®дҝЎжҠҘеҗҚгҖӮ
|